Secara garis besar, baterai adalah perangkat yang mengubah energi kimia menjadi energi listrik melalui reaksi elektrokimia.
Berikut adalah jenis-jenis baterai yang paling umum digunakan saat ini, bahan penyusunnya, dan mekanisme kerjanya:
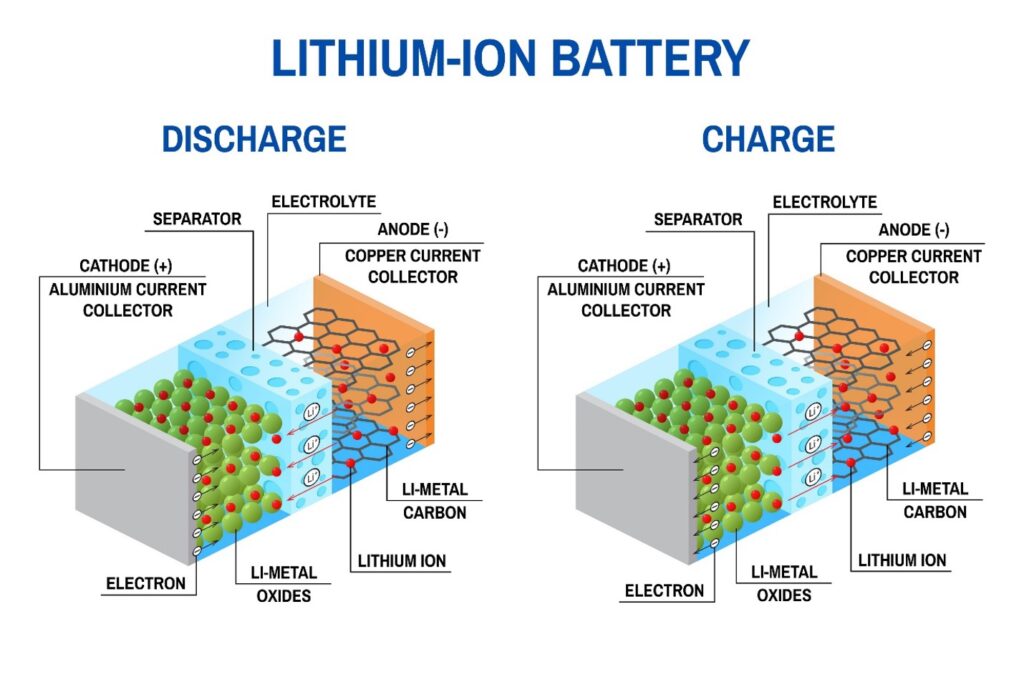
1. Baterai Li-ion (Lithium-ion)
Baterai Lithium-ion (Li-ion) memiliki kelebihan utama berupa kepadatan energi yang tinggi sehingga ukurannya relatif kecil dan ringan namun mampu menyimpan daya besar, dapat diisi ulang ratusan hingga ribuan kali, tidak memiliki memory effect, serta tingkat kehilangan daya saat tidak digunakan tergolong rendah. Karena karakter ini, baterai Li-ion sangat luas digunakan pada smartphone, laptop, kamera, power bank, kendaraan listrik, hingga sistem penyimpanan energi panel surya. Namun di balik keunggulannya, baterai ini juga memiliki kelemahan, seperti sensitif terhadap panas dan pengisian berlebih, berpotensi mengalami degradasi kapasitas seiring waktu, serta membutuhkan sistem manajemen baterai (BMS) agar tetap aman. Selain itu, produksi baterai Li-ion masih bergantung pada bahan tambang strategis seperti lithium dan nikel, sehingga aspek biaya, pasokan, dan daur ulang menjadi tantangan penting dalam pengembangannya ke depan.
• Bahan Penyusun:
o Anode (Kutub Negatif): Biasanya terbuat dari grafit (karbon).
o Katode (Kutub Positif): Campuran logam litium, seperti Lithium Cobalt Oxide ($LiCoO_2$) atau Lithium Iron Phosphate ($LiFePO_4$).
o Elektrolit: Garam litium dalam pelarut organik cair.
• Cara Kerja: Saat baterai digunakan (discharged),ion litium bergerak dari anode ke katodemelalui elektrolit. Saat diisi ulang (charged), prosesnya terbalik: ion dipaksa kembali ke anode.
Bagaimana Listrik Tercipta?
Pada dasarnya, semua baterai bekerja melalui Reaksi Redoks (Reduksi-Oksidasi):
1. Di Anode, terjadi oksidasi di mana elektron dilepaskan.
2. Elektron ini tidak bisa lewat melalui elektrolit, sehingga mereka terpaksa mengalir melaluikabel/sirkuit luar (inilah yang menghidupkan perangkat Anda).
3. Elektron tersebut berakhir di Katode (Reduksi), menyelesaikan siklus listrik tersebut.
2. Baterai Lead-Acid (Asam Timbal)
Baterai Lead-Acid (aki) adalah jenis baterai isi ulang konvensional yang menggunakan pelat timbal (lead) dan larutan asam sulfat sebagai elektrolit, dan hingga saat ini masih sangat luas digunakan karena konstruksinya sederhana, kuat, dan biaya produksinya relatif murah. Baterai ini umum dipakai pada kendaraan bermotor (aki mobil dan motor), sistem starter mesin, UPS, sistem tenaga cadangan, pembangkit listrik darurat, hingga penyimpanan energi skala kecil. Kelebihan utama baterai Lead-Acid terletak pada kemampuan memberikan arus besar secara instan, teknologi yang sudah matang, mudah diproduksi, serta tingkat daur ulang yang tinggi. Namun, kelemahannya adalah berat dan besar, kepadatan energi rendah dibanding baterai modern seperti Li-ion, umur pakai lebih pendek, serta membutuhkan perawatan pada tipe tertentu (seperti pengecekan air aki). Meski mulai tergeser di sektor kendaraan listrik, baterai Lead-Acid masih tetap relevan untuk aplikasi industri dan otomotif karena keandalannya dan biaya yang efisien.
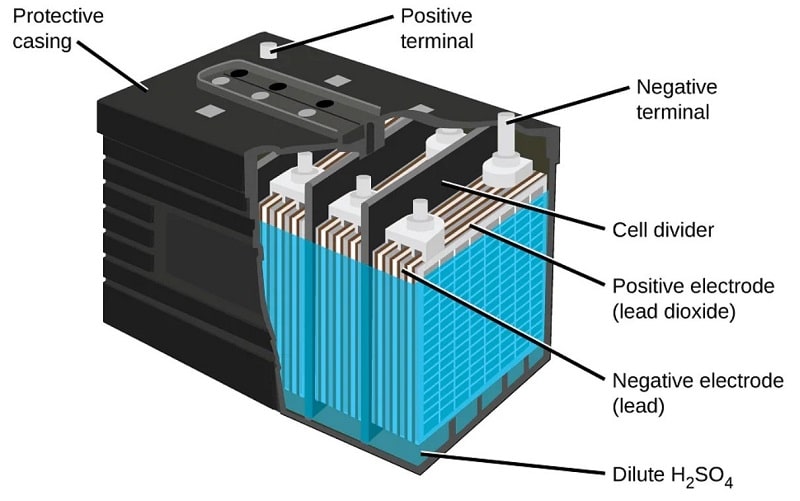
• Bahan Penyusun:
o Anode: Timbal murni ($Pb$).
o Katode: Timbal dioksida ($PbO_2$).
o Elektrolit: Larutan asam sulfat ($H_2SO_4$) dan air.
• Cara Kerja: Terjadi reaksi kimia yang mengubah kedua pelat (anode dan katode) menjadi timbal sulfat saat mengeluarkan daya. Proses ini sangat andal untuk memberikan lonjakan arus besar dalam waktu singkat.
Bagaimana Listrik Tercipta?
Pada dasarnya, semua baterai bekerja melalui Reaksi Redoks (Reduksi-Oksidasi):
1. Di Anode, terjadi oksidasi di mana elektron dilepaskan.
2. Elektron ini tidak bisa lewat melalui elektrolit, sehingga mereka terpaksa mengalir melalui kabel/sirkuit luar (inilah yang menghidupkan perangkat Anda).
3. Elektron tersebut berakhir di Katode (Reduksi), menyelesaikan siklus listrik tersebut.
3. Baterai NiMH (Nickel-Metal Hydride)
Baterai NiMH (Nickel-Metal Hydride) adalah jenis baterai isi ulang yang menggunakan nikel oksihidroksida sebagai elektroda positif dan paduan logam penyerap hidrogen sebagai elektroda negatif, dan dikenal sebagai teknologi transisi antara baterai konvensional dan baterai modern. Baterai ini banyak digunakan pada perangkat elektronik portabel, kamera digital, mainan elektronik, peralatan medis, serta kendaraan hibrida (hybrid electric vehicle) karena relatif aman dan stabil. Kelebihan baterai NiMH meliputi kapasitas yang lebih besar dibanding Ni-Cd, lebih ramah lingkungan karena tidak mengandung kadmium beracun, serta daya tahan yang cukup baik terhadap siklus pengisian ulang. Namun, kelemahannya adalah self-discharge yang lebih tinggi, bobot yang masih cukup berat, serta efisiensi yang kalah dibanding baterai Lithium-ion, sehingga penggunaannya kini lebih terbatas pada aplikasi tertentu yang mengutamakan keamanan dan keandalan dibanding ukuran dan bobot.
• Bahan Penyusun:
o Anode: Paduan penyerap hidrogen (logam langka seperti Lanthanum atau Neodymium).
o Katode: Nikel hidroksida ($NiOOH$).
o Elektrolit: Kalium hidroksida ($KOH$).
• Cara Kerja: Energi disimpan dalam bentuk hidrogen di dalam paduan logam anode. Baterai ini lebih ramah lingkungan dibandingkan pendahulunya, NiCd (Nickel-Cadmium), karena tidak mengandung kadmium yang beracun.

Bagaimana Listrik Tercipta?
Pada dasarnya, semua baterai bekerja melalui Reaksi Redoks (Reduksi-Oksidasi):
1. Di Anode, terjadi oksidasi di mana elektron dilepaskan.
2. Elektron ini tidak bisa lewat melalui elektrolit, sehingga mereka terpaksa mengalir melalui kabel/sirkuit luar (inilah yang menghidupkan perangkat Anda).
3. Elektron tersebut berakhir di Katode (Reduksi), menyelesaikan siklus listrik tersebut.
